Kuis 3
Chapter 1
1. Segala sesuatu yang menempati ruang dan memiliki massa disebut
a. materi
b. unsur
c. senyawa
d. campuran
Jawaban : a
Pembahasan :
Materi dalam pengertian ilmu kimia merupakan segala sesuatu yang memiliki masa dan memiliki volume, atau dalam kata lain, materi adalah segala sesuatu yang menempati ruang.
2. Hukum kekekalan massa menyatakan bahwa
a. massa zat sebelum dan sesudah reaksi adalah berubah
b. massa zat hilang setelah reaksi
c. massa zat sebelum dan sesudah reaksi adalah tetap
d. massa zat selalu berubah
Jawaban : c
Pembahasan :
Hukum kekekalan massa atau dikenal juga sebagai hukum Lomonosov-Lavoisier adalah suatu hukum yang menyatakan massa dari suatu sistem tertutup akan konstan meskipun terjadi berbagai macam proses di dalam sistem tersebut (dalam sistem tertutup Massa zat sebelum dan sesudah reaksi adalah sama (tetap/konstan).
Chapter 2
1. Pebedaan antara molekul unsur dan molekul senyawa adalah
a. molekul senyawa tidak tersusun dari atom-atom
b. molekul senyawa mengandung atom-atom yang lebih banyak
c. molekul senyawa mengandung atom-atom yang lebih dari satu jenis
d. molekul senyawa memiliki massa yang lebih besar
Jawaban : c
Pembahasan :
Molekul unsur terdiri dua atau lebih atom yang sejenis misalnya O. Sedangkan molekul senyawa terdiri dari atom-atom yang berbeda macamnya, misalnya Nacl.
2. Lambang suatu unsur ![]() dapat disimpulkan bahwa pada satu atom unsur X mempunyai
dapat disimpulkan bahwa pada satu atom unsur X mempunyai
a. 18 neutron dan 18 proton
b. 22 neutron dan 22 proton
c. 40 proton dan 18 elektron
d. 18 proton dan 22 neutron
Jawaban : d
Pembahasan :
Nomor atom suatu unsur menunjukkan banyaknya proton atau banyaknya elektron. Sedangkan banyaknya neutron adalah Nomor Massa dikurangi
Nomor Atomnya.
![]() berarti unsur tersebut mempunyai 18 proton dan 18 elektron, dan (40 – 18) = 22 neutron.
berarti unsur tersebut mempunyai 18 proton dan 18 elektron, dan (40 – 18) = 22 neutron.
Chapter 3
1. Sebanyak 4,0 gram cuplikan yang mengandung senyawa hidrokarbon dibakar sempurna dengan gas oksigen. Jika presentase (%) massa karbon dalam cuplikan tersebut adalah 30%, maka massa karbon dioksida yang dihasilkan dalam proses pembakaran tersebut adalah (Ar C = 12, O = 16)
a. 3,3
b. 4,4
c. 5,4
d. 5,5
Jawaban : b
Pembahasan :
dengan menganggap massa sebelum = massa sesudah reaksi, maka massa C dalam cuplikan akan sama dengan massa C dalam CO2. Sehingga:
(Ar Fe = 56, Cl = 35,5, H = 1, S = 32, N = 14)
a. 25%
b. 35%
c. 45%
d. 75%
Jawaban : d
Pembahasan :
FeS + 2HCl → FeCl2 H2S
Jumlah gas H2S yang dihasilkan dari reaksi diukur pada keadaan gas Nitrogen → Hukum Avogadro

Karena koefisien FeS = koefisien H2S, maka mol FeS = mol H2S. Sehingga :
nH2S = nFeS = 0,75 mol
massa FeS = (0,75 mol x 88 gram/mol)
massa FeS = 66 gram

Chapter 4
1. Berapakah konsentrasi ion [OH–] dalam larutan jika konsentrasi H+ = 2 X 10-4 M (Diketahui Kw = 10-14)
a. 5 X 10-10
b. 5 X 10-18
c. 0,2 X 10-10
d. 0,2 X 10-8
Jawaban : a
Pembahasan :Dalam larutan dengan pelarut air, berlaku :
a. AgNO3 (aq) + NaCl (aq) → AgCl (s) + NaNO3 (Aq)
b. 2KI (aq) + Cl2 (aq) → I2 (s) + 2KCI (aq)
c. NH3 (aq) + H2O (l) → NH4+ (aq) + OH– (aq)
d. NaOH (aq) + CH3COOH (aq) → CH3COONa (aq) + H2O (l)
Jawaban : b
Pembahasan :
Chapter 6
1. Sebuah Kristal KNO3 dimasukkan ke dalam tabung reaksi kemudian ditetesi dengan air. Pada tabung reaksi terasa dingin. Reaksi ini dapat digolongkan
b. Eksoterm, energi berpindah dari lingkungan kesistem
c. Endoterm, energi berpindah dari sistem ke lingkungan
d. Endoterm, energi berpindah dari lingkungan ke sistem
Jawaban : d
Pembahasan :
Pada percobaan tersebut dikatakan endoterm, karena pada saat KNO3 beraksi dengan air, temperature nya turun karena tabung reaksi terasa dingin. Setelah sampai pada titik terendah, lama-kelamaan temperature akan naik kembali sampai temperature awal.
Penurunan temperature pada saat KNO3 bereaksi dengan air, menunjukkan bahwa reaksi menyerap kalor . Pada reaksi endoterm reaksi yang menyerap kalornya berpindah dari lingkungan ke sistem, sehingga kalor dari sistem akan bertambah. Sehingga lingkungannyaa terasa dingin atau pada soal lingkungannya tabung reaksi.
2. Entalpi pembakaran asetilena adalah -1300 kJ, entalpi pembentukan asetilena, C2H2 adalah
(ΔHf° CO2 = -395 ; ΔHf° H2O = -285 )
a. -225 kJ
b. +225 kJ
c. -450 kJ
d. +450 kJ
Jawaban : b
Pembahasan :
a. 1 x 1019 foton
b. 2 x 1019 foton
c. 2 x 1020 foton
d. 5 x 1020 fotonEnergi 1 foton
Jumlah foton tiap sekon tiap satuan luas adalah :
2. Berdasarkan percobaan hamburan sinar alfa yang dilakukan oleh Rutherford dihasilkan teori bahwa bagian terbesar dari suatu atom adalah ruang kosong. Kesimpulan tersebut diambil berdasarkan fakta
a. Sebagain besar sinar diteruskan
b. Ada sinar yang dipantulkan
c. Sebagian kecil sinar dibelokkan
d. Sebagian besar sinar dihamburkan
Jawaban : a
Pembahasan :
Fakta tersebut diambil berdasarkan fakta bahwa partikel alfa dari zat radioaktif yang ditembakkan ke lempengan emas super duper tipis banyak partikel yang diteruskan oleh lempeng emas tersebut bukannya malah dipantulkan.
Chapter 8
1. Letak unsur X dengan nomor atom 26 dan nomor massa 56 dalam sistem periodik unsur terletak pada golongan dan periode
a. IIA dan 6
b. VIB dan 3
c. VIB dan 4
d. VIIIB dan 4
Jawaban : d
Pembahasan :
Menentukan letak unsur
![]()
Ingat bahwa 4s 3d merupakan salah satu karakteristik konfigurasi elektron unsur golongan B. Dari konfigurasi di atas diperoleh :
n = 4 → periode 4
eval (s+d) = 2 + 6 = 8 → golongan VIIIB
2. Nomor atom unsur X sama dengan 27. Jumlah elektron tidak berpasangan dalam ion X+2 adalah
a. 1
b. 2
c. 3
d. 5
Jawaban : c
Pembahasan :
Jumlah elektron tidak berpasangan

Diagram elektronnya berdasarkan aturan Hund :
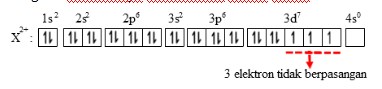
Jadi jumlah elektron yang tidak berpasangan pada ion tersebut adalah 3 elektron.
Chapter 9
1. Perbedaan antara ion Na+dengan atom natrium adalah
a. Ion Na+ kelebihan 1 proton
b. Ion Na+ kelebihan 1 elektron
c. Ion Na+ kekurangan 1 elektron
d. Ion Na+ kekurangan 1 proton
Jawaban : c
Pembahasan :
Ion Na+ memiliki ion positif maka kekurangan satu elektronnya, dari yang 11 nomor atomnya menjadi 10 disebabkan melepaskan 1 elektron. Ion Na+ ini melepaskan 1 elektron untuk mencapai kestabilannya. beda dengan Na yang nomor atomnya 11. Dilihat dari konfigurasi elektronnya:
Na+ : 2 8
Na : 2 8 1
Dilihat ev nya makanya, Na+ kekurangan elektronnya.
Ikatan paling ionic dapat terbentuk antara pasangan unsur
a. Na dengan F
b. F dengan Ne
c. B dengan Be
d. Na dengan Ne
Jawaban : a
Pembahasan :
Energy ionisasi adalah energy minimum yang diperlukan atom netral dalam wujud gas untuk melepas suatu electron paling luar yang terikat paling lemah membentuk ion positive. Dalam suatu periode semakin kekanan semakin besar energy ionisasinya,
sehingga jika diliat dalam soal, untuk pasangan unsur yang paling dapat terbentuk yaitu Na dan F, kita tahu bahwa F merupakan golongan VIIA yang harus menyerap 1 elektron agar stabil. Jika kita lihat pada energy ionisisasi, Ne paling besar, tetapi Ne adalah golongan VIIIA, golongan gas mulia, yang sudah stabil sehingga sukar untuk bereaksi.
Chapter 10
1. CH4 mempunyai struktur tetrahedral, dengan empat buah domain elektron ikatan pada empat arah yang sama. Maka bentuk hibridisasi yang terjadi pada CH4 adalah
A. sp
B. sp3
C. sp3d2
D. sp2
Jawaban : b
Pembahasan :
Konfigurasi elektron atom 6C = 1s2 2s2 sp2
Empat elektron yang tidak berpasangan pada konfigurasi elektron C terhibridisasi akan berpasangan dengan elektron dari atom H sehingga membentuk orbital hibrid sp3 (tetrahedral).
2. Jika nomor atom B adalah 5 dan nomor atom F adalah 9, maka hibridisasi dari BF3 adalah
a. a. sp2
b. sp
c. sp3d
d.
Jawaban : a
Pembahasan :
Nomor atom B adalah 5 dan F adalah 9. Senyawa BF3, memiliki atom pusat di B, sehingga diperoleh:

Oleh karena orbital yang terlibat adalah orbital s dan dua orbital p, maka jenis hibridisasinya sp2.
Jadi, hibridisasi dari BF3 adalah sp2.
Chapter 11
1. Di antara senyawa berikut, manakah yang molekul-molekulnya dapat membentuk ikatan hidrogen?
a. CHCl3
b. CH3OH
c. CH3F
d. CH3OCH3
Jawaban : b
Pembahasan :
Ikatan hidrogen hanya dapat terbentuk di antara atom
elektronegatif N, O, atau F yang memiliki pasangan elektron bebas dan atom H
yang berikatan dengan atom elektronegatif N, O, atau F.
Senyawa yang molekul-molekulnya dapat berikatan hidrogen
harus memiliki atom N, O, atau F yang berikatan langsung dengan H ( ikatan N-H,
O-H, F-H )
Oleh karena itu, CH3OH dapat berikatan hidrogen, sebagaimana terdapat atom O dan atom H yang saling berikatan ( ikatan O-H )
2. Manakah molekul yang memiliki gaya tarik-menarik dipol-dipol antar molekulnya?
a. AsH3
b. BCl3
c. Cl2
d. CO2
Jawaban : a
Pembahasan :
Molekul-molekul akan memiliki gaya dipol-dipol bila molekul tersebut bersifat polar.
Setiap atom kebanyakan akan stabil bila elektron valensinya berjumlah 8 atau 2. Untuk senyawa kovalen bisa dicapai dengan menggunakan pasangan elektron bersama atom-atom lain.
As atom pusat (jumlahnya hanya 1 atom).
As mempunyai e-valensi 5
H atom luar dengan e-valensi 1
H merupakan atom monovalen (perlu 1 elektron lagi untuk stabil)
H berjumlah 3 atom → X3
Jumlah EB = valensi atom pusat – (jumlah atom luar × elektron yang diperlukan per atom)
Jumlah EB = 5 – (3 × 1) = 5 – 3 = 2
PEB = jumlah EB/2 = 2/2 = 1 → E1
Keterangan EB = elektron bebas, PEB = pasangan elektron bebas
AsH3→ sistem AX3E1 atau AX3E
AX3E → Bentuk molekul piramida segitga → polar
Jadi yang memiliki gaya tarik adalah AsH3 , sehingga AsH3 bersifat polar
Chapter 12
1. Larutan fruktosa dengan konsentrasi 1,476 M mempunyai massa jenis 1,2 g/ml. Berapa kemolalan larutan tersebut (Mr fruktosa = 180)
a. 1,75 mol/kg
b. 1,87 mol/kg
c. 1,77 mol/kg
d. 1,85 mol/kg
Jawaban : c
Pembahasan :
Basis perhitungan 1 L larutan fruktosa
Kemolalan laerutan fruktosa, m = n fruktosa / w air x 1.000
Diketahui, dalam 1 L larutan
– mol fruktosa, n Fruktosa = 1,476 mol
– menghitung massa air, w air = w larutan –w froktosa
Massa larutan
= ρ x V
= 1,1 g/Ml x 1000 ml
= 1100 g
Massa fruktosa = n fruktosa x Mm
= 1,476 mol x 180 g/mol
= 265,6 g
Diperoleh w air = w larutan – w fruktosa = 1100 g – 265,6 g = 834,4 g
Jadi, kemolalan larutan fruktosa
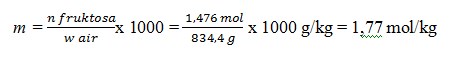
2. Sebanyak 11,7 gram NaCl (Mr = 58,5) dilarutkan dalam 500 gram air. Titik didih larutan adalah …. (Kb air = 0,52oC/m)
a. 100,420C
b. 98,90C
c. 50,890C
d. 1000,540C
Jawaban : a
Pembahasan :
Reaksi ionisasi : NaCl(aq) → Na + + Cl –(aq)
n = banyaknya ion =1 + 1 = 2
jika derajat ionisasi tidak diketahui, α dianggap 1.
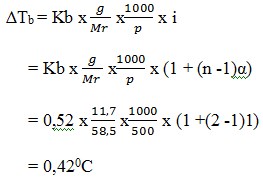
Titik didih NaCl = 1000C + 0.420C = 100,420C
Jawa









Tidak ada komentar:
Posting Komentar